中药配方颗粒丨备案管理实施在即,您还在为标准发愁吗?

导 读
2月10日,国家药品监督管理局、国家中医药管理局等四部门联合发布《关于结束中药配方颗粒试点工作的公告》(以下简称《公告》),自2021年11月1日起结束中药配方颗粒(以下简称配方颗粒)试点工作,对配方颗粒实行备案管理。质量标准作为衡量配方颗粒产品质量的标尺,也是备案资料中的关键技术文件,在《公告》中进行了明确规定:不具有国家药品标准或省级药品监管部门制定标准的配方颗粒不得上市销售。
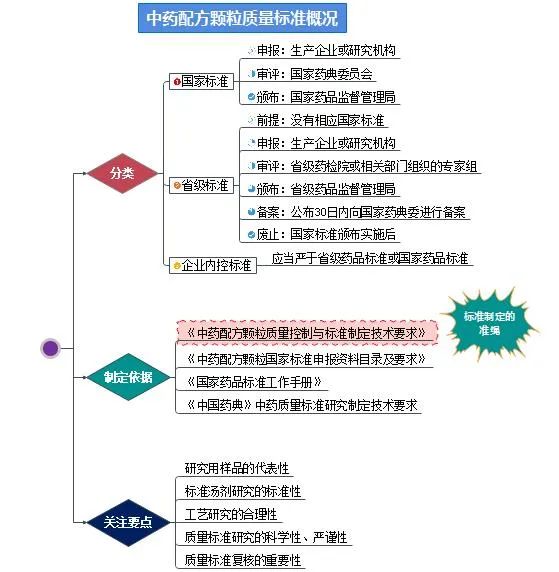
配方颗粒质量标准概况
为规范配方颗粒的质量控制和标准研究,国家药监局组织制定了《中药配方颗粒质量控制与标准制定技术要求》(以下简称技术要求),与《公告》同日向社会发布。《技术要求》是配方颗粒标准制定的准绳。2021年4月29日,国家药品监督管理局批准颁布了首批160个配方颗粒品种国家标准,涉及约1/3的常用中药材品种,设置6个月的过渡期,2021年11月1日起正式实施;4月30日,国家药典委员会公布了第二批36个配方颗粒国家标准的公示稿,此外还有246个品种已有企业正在开展标准研究。对于无国家标准的配方颗粒品种,省级质量标准的制定刻不容缓。
点击查看大图
配方颗粒标准研究内容
《技术要求》体现了“全过程管理”的管理理念,从基本要求、原辅料、标准汤剂、生产工艺、标准制定、稳定性和标准复核等方面规范了标准研究制定的过程。以下结合《技术要求》和《中药配方颗粒国家标准申报及目录要求》归纳了配方颗粒标准研究的主要内容及相关的分析手段:

点击查看大图
岛津《中药配方颗粒质量标准解决方案》
配方颗粒试点工作结束意味着将有更多符合生产条件的企业加入到配方颗粒行业当中。未来配方颗粒市场将具有广阔的市场前景,相关企业拥有更多机遇的同时也面临较大的挑战,比如需要按照新的《技术要求》规范配方颗粒的质量控制和标准制定。为了应对相关企业对配方颗粒标准研究和质量控制的需求,岛津与国内知名配方颗粒企业共同合作,总结经验并结合最新政策精心推出《中药配方颗粒质量标准解决方案》,为您排忧解愁!

点击查看大图
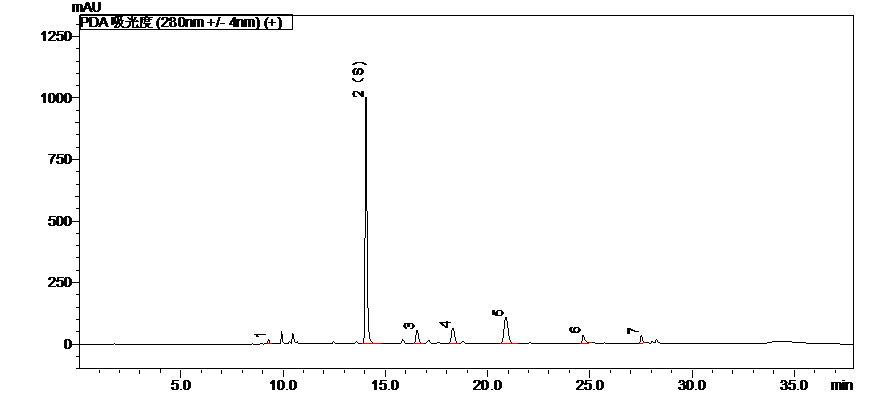
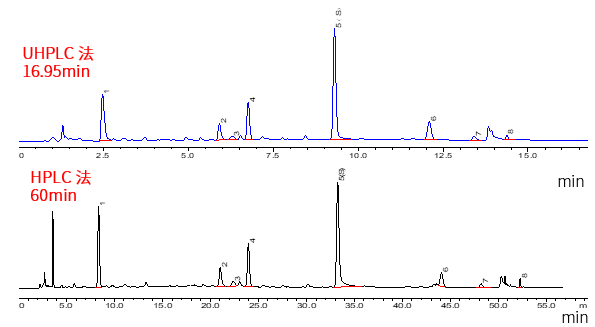
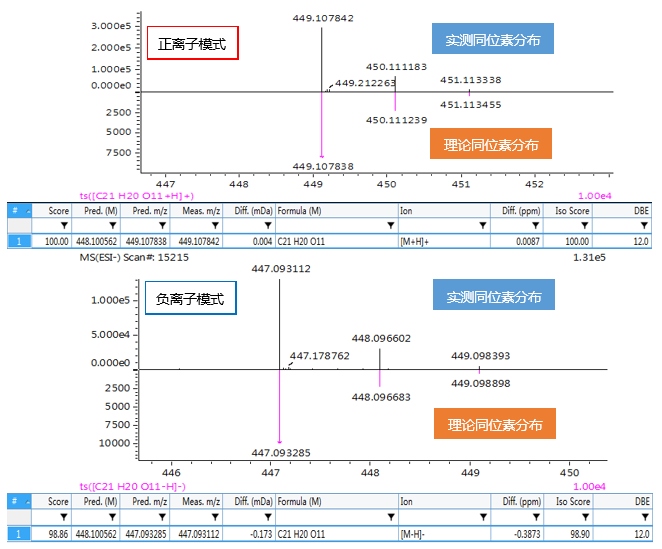
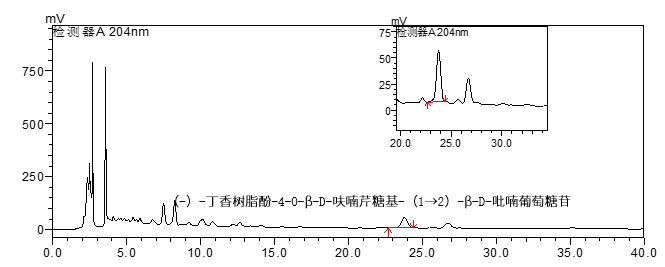
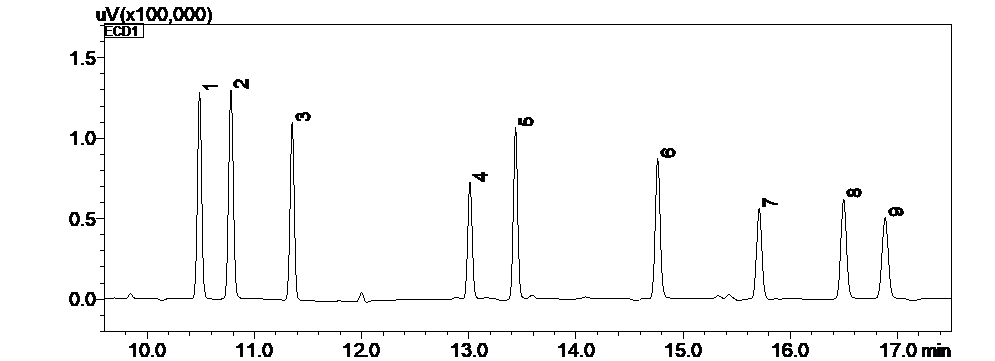
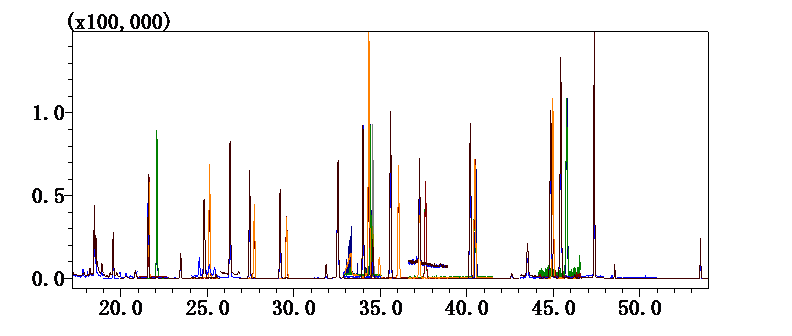
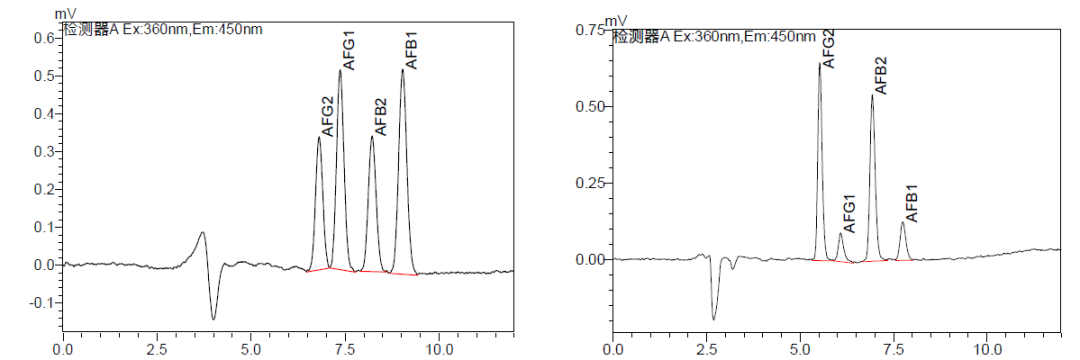
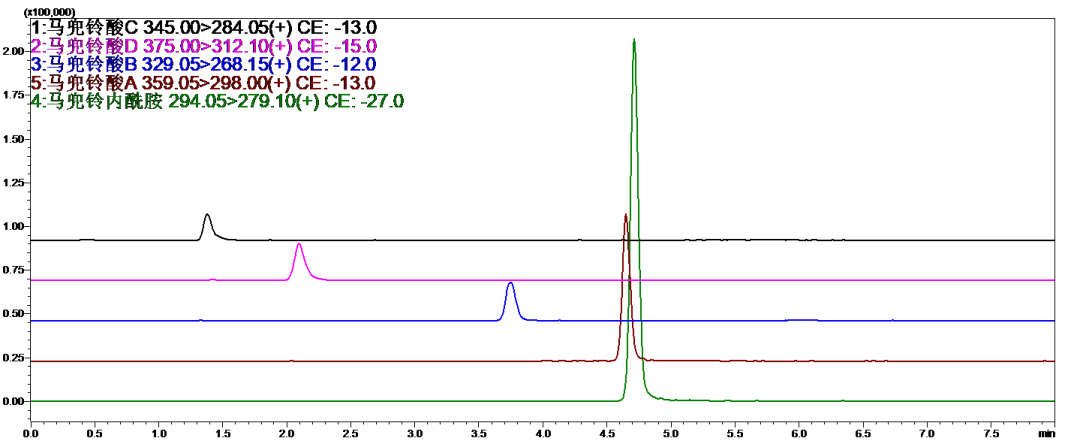
配方颗粒典型分析方案抢先看
上下滑动查看更多

识别二维码下载
岛津《中药配方颗粒
质量标准解决方案》
相关阅读
撰稿人:陈丽枝