XPS小课堂丨价态越高结合能一定高?NO!NO!NO!
X P S
X射线光电子能谱技术是一种检测表面信息的无损检测技术。可以通过测定电子结合能来分析化学键成键情况和元素价态等化学信息。

XPS能够检测元素的不同化学状态,通常认为当原子失去电子的时候(即元素处于高价状态),轨道上电子的结合能会增加,表现在XPS谱峰上,就是图谱会向高结合能端偏移(如图1所示);相反,当原子得到电子的时候(处于负价态),轨道电子的结合能会降低(如图2所示)。
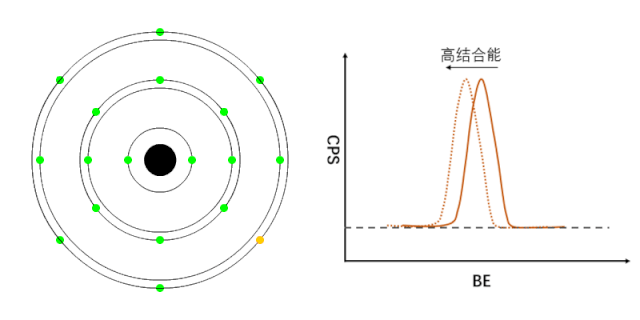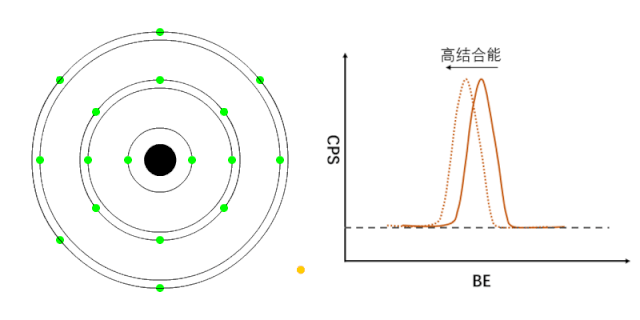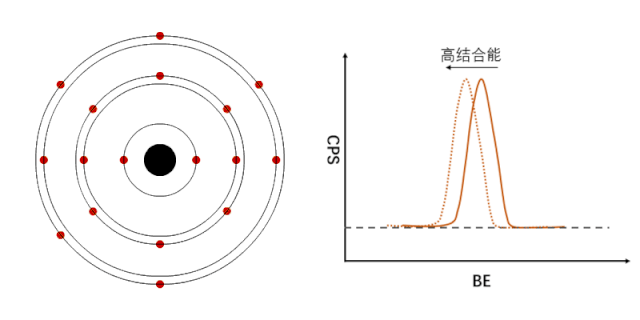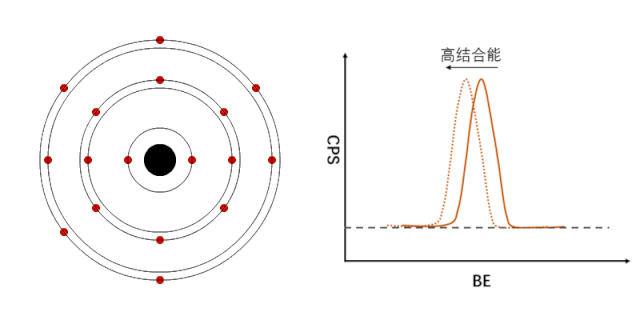
图1 正价元素电子结合能的变化[1]
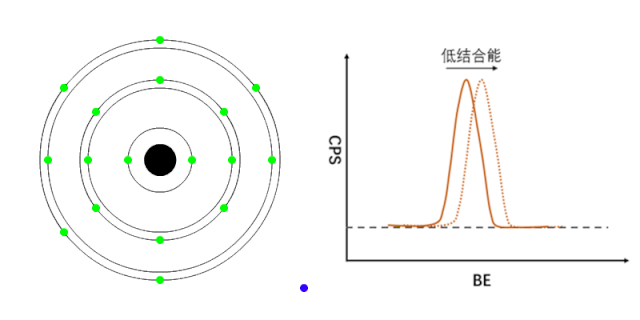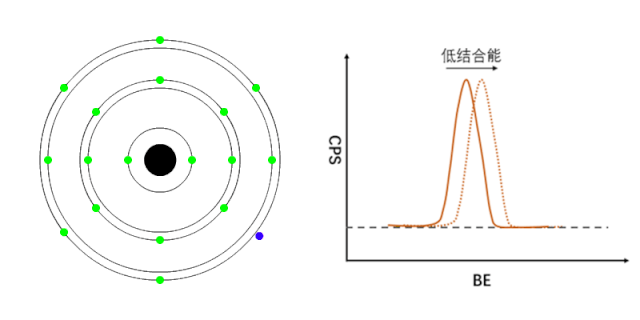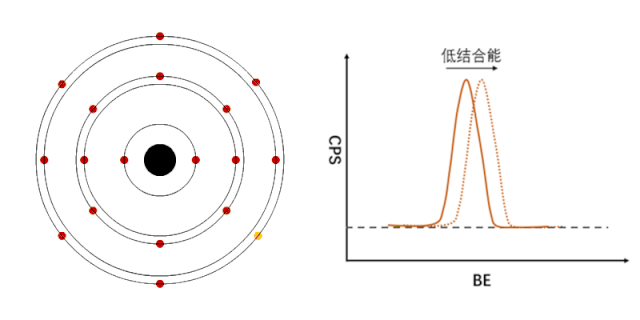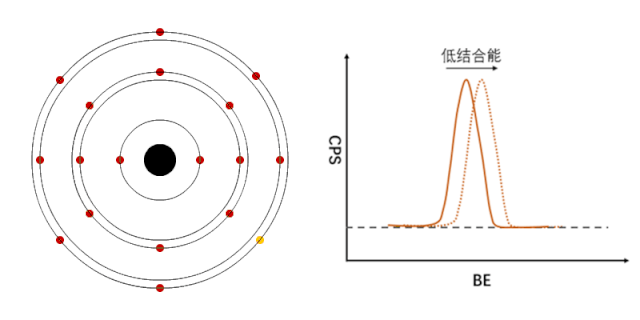
图2 负价元素电子结合能的变化[1]
案例分析—氧空位XPS分析
O2-离子是2p轨道完全填满电子的状态,是最稳定的状态,所以当一个电子转移走了之后(即出现了一个空穴,此时O2-应该变成了O-),那么O- 2p的结合能与O2-相比一定是升高的,因为原子核对和外的所有电子的束缚都加强了,包括1s和2s电子。当然,和O的自由状态(所谓的0价)相比,结合能仍然要低一些,因为此时有一个电子向着O转移过来了,原子核对核外电子的束缚下降了。故在文献中,我们常常能看到自由氧、氧空位、吸附氧的结合能是依次增加的。

并不是所有的元素都遵循这个准则,我们看看都有哪些元素离经叛道呢?
Ba
我们从标准手册Ba元素的结合能分布看,Ba的化合物的结合能低于单质的结合能,和我们上述的理论就不一致了,这是为什么呢?
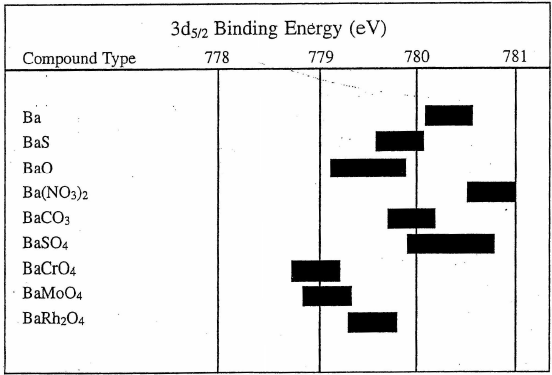
图3 Ba元素结合能[2]
这就要从Ba的外层电子排布说起
Ba[56]1s22s22p63s23p63d104s24p64d105s25p66s2 即[Xe]6s2
基于Ba的外层电子分布我们可以看到最外层是6s2的两个电子,按照当Ba的周围电负性的原子或原子团(如S、O、Cl、F或其他酸根、氢氧根)存在的时候,这两个电子就很容易被这些原子或原子团俘获了,特殊情况出现了——这时候的Ba的电子结构反而非常像氙(Xe)元素,最外层是稳定的8个电子,所以内壳层的3d电子的结合能不升反降了。
但是当电负性的基团的电负性过于强烈的时候,还是会导致3d电子的结合能升高的,例如硝酸根和硫酸根等。查看NIST数据库里面的数据,会发现超过780.6eV(Ba)的那些化合物,基本上都是含有硝酸根(NO3-)、硫酸根(SO42-)、高氯酸根(ClO4-)等,另外过氧化物(BaO2)也是一样。
Cs
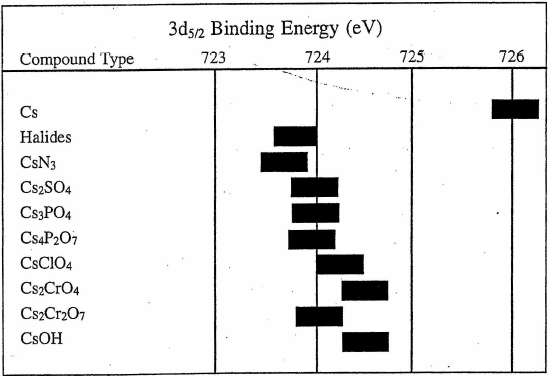
图4 Cs元素结合能[2]
Cs [55] 1s22s22p63s23p63d104s24p64d105s25p66s1
比起Ba则更加明显,由于外层只有1个电子,外层更加容易失去一个电子变成[Xe]的稳定结构。


类似的还有Ru、Sr、Ag、La、Ce等元素
Ru[37] 1s22s22p63s23p63d104s24p65s1
Sr[38] 1s22s22p63s23p63d104s24p65s2
Ag[47] 1s22s22p63s23p63d104s24p64d105s1
La[57] 1s22s22p63s23p63d104s24p64d104f15s25p66s2
Ce[58] 1s22s22p63s23p63d104s24p64d104f25s25p66s2
上述元素的外层电子排布结构可以看出,这些元素的电子壳层较多,当失去最外层电子时,元素处于更稳定的状态,使得部分化合物中该元素的结合能位置要低于单质的结合位置。


以上就是隐藏在元素周期表中一些反叛的元素,遇到它们,请不要惊慌,不合常理但还是有存在的道理~
[1] XPS(X射线光电子能谱仪)|基本原理简介(一)
[2] Handbook of X-ray Photoelectron Spectroscopy
本文内容非商业广告,仅供专业人士参考。
扫一扫
关注我们的视频号


关注我们
及时获取科技资讯。

