2025年版《中国药典》将于10月1日实施,岛津生物制品综合解决方案助力新标准应对

导

语
DAO YU
2025年3月25日,国家药监局、国家卫生健康委发布关于颁布2025年版《中华人民共和国药典》的公告。公告明确根据《中华人民共和国药品管理法》,2025年版《中华人民共和国药典》(以下简称《中国药典》)经第十二届药典委员会执行委员会全体会议审议通过,现予颁布,自2025年10月1日起施行。
其中,中国药典三部生物制品收载品种共计153种,新增13种,修订62种,不再收载13种;通用技术要求新增13个,修订31个;指导原则新增5个;总论新增1个。此外还将继续关注生物制品分段生产模式逐渐兴起后与之对应的生产与监管模式的新变化,致力于制定科学合理、切实有助于监管的标准管理体系。探索将人工智能和大数据技术融入标准制定,构建以数据准确性为基础的质量标准与风险评估体系,让可靠数据推动标准制定水平的持续提升,继续在公共卫生安全保障和科研创新技术支持上发挥国家标准的应有作用。
针对新版药典标准发布,岛津技术团队做了研读,开展了标准复现实验工作,制定了全流程解决方案,助力行业相关单位开展标准扩项和建立检测能力,应对新标准实施准备工作。

点击上方图片
直达岛津中国网站“2025年《中国药典》岛津解决方案集”专刊
2025年版《中国药典》三部收载情况汇总
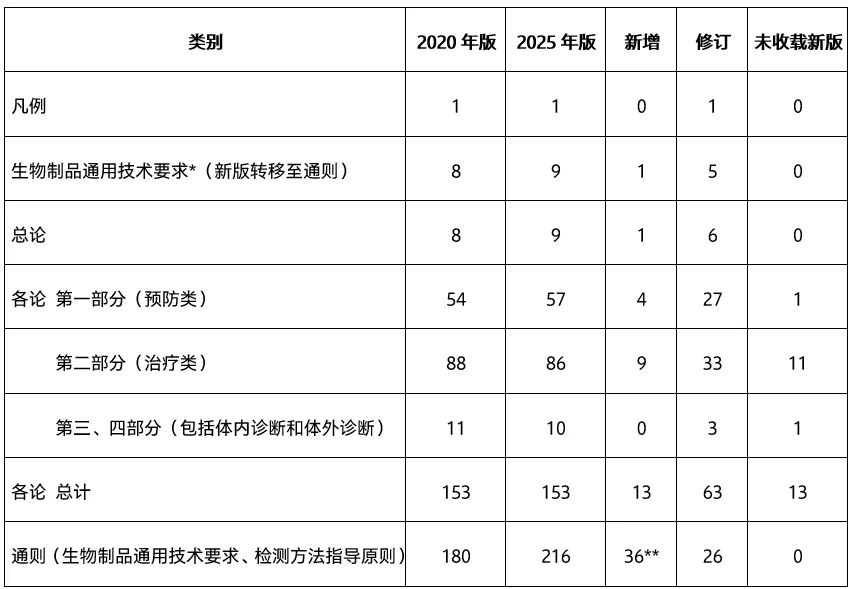
* :2025年版《中国药典》将生物制品通用技术要求内容全部转移至通则0231至0239。
** :包括原2020年版生物制品通用技术要求9个统一调整至通则,增加收载四部通则10个,增订通则和指导原则17个。
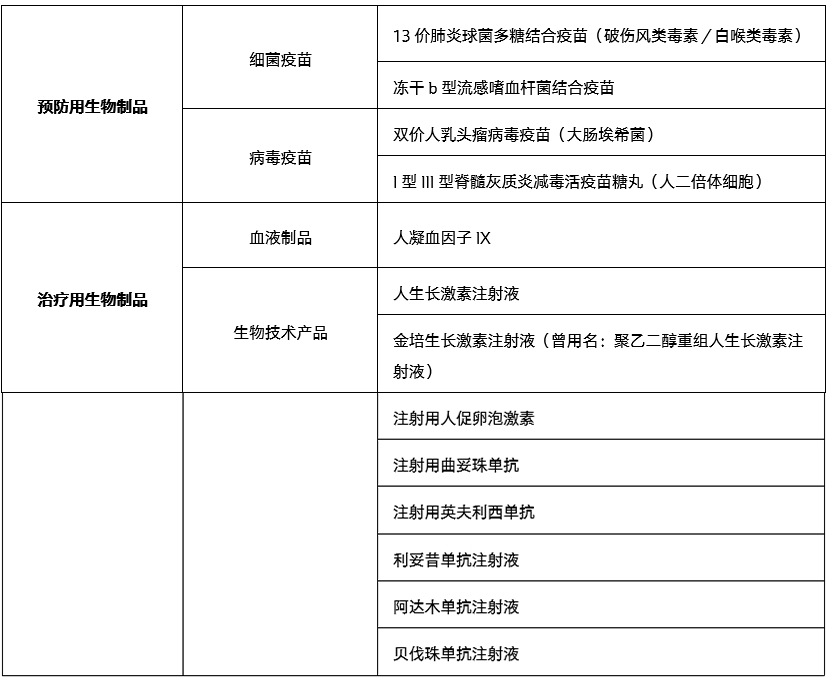
2025年版《中国药典》三部新增品种
参考文献:
[1] 曹琰,赵雄,王晓娟,等.2025年版《中国药典》三部增修订概况[J].中国药品标准, 2025,26(01):28-33. DOI:10.19778/j.chp.2025.01.005
[2] 中华人民共和国药典2025年版.三部[S].2025.ChP 2025.Vol III [S] .2025.
2025年版《中国药典》三部生物制品综合解决方案
1. 分析仪器


2. 通则消耗品方案

● 聚集体分析
● 药物抗体比值(DAR)分析
● 细胞培养上清液分析
● 寡核苷酸药物分析
● 电荷异质性分析
● 肽图分析
● 糖基化分析
● mRNA疫苗分析
扫描下方二维码
在线阅读生物药行业耗材选型卡

3、应用数据集


利用疏水色谱法(HIC)分析ADCs药物抗体偶联比
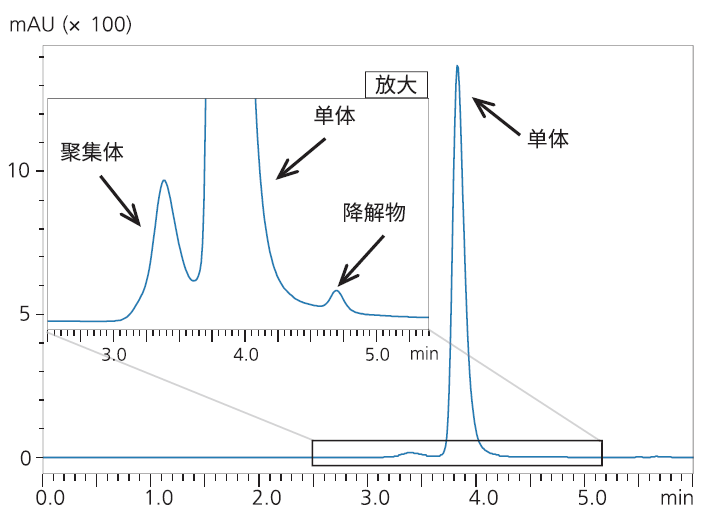
使用分子排阻色谱法(SEC)分析mAb杂质
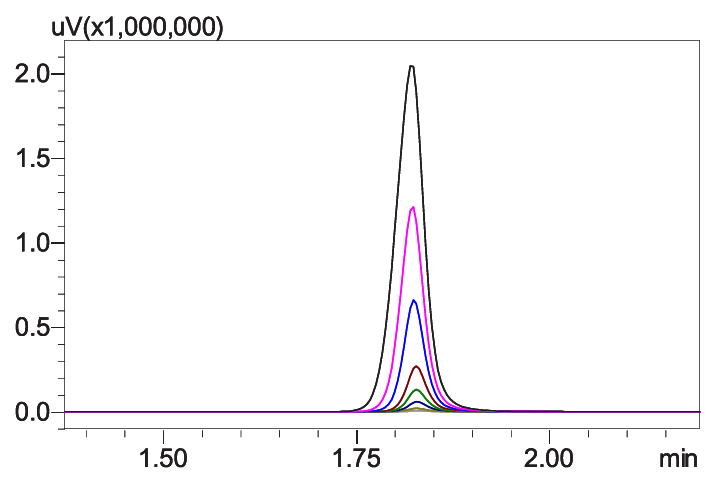
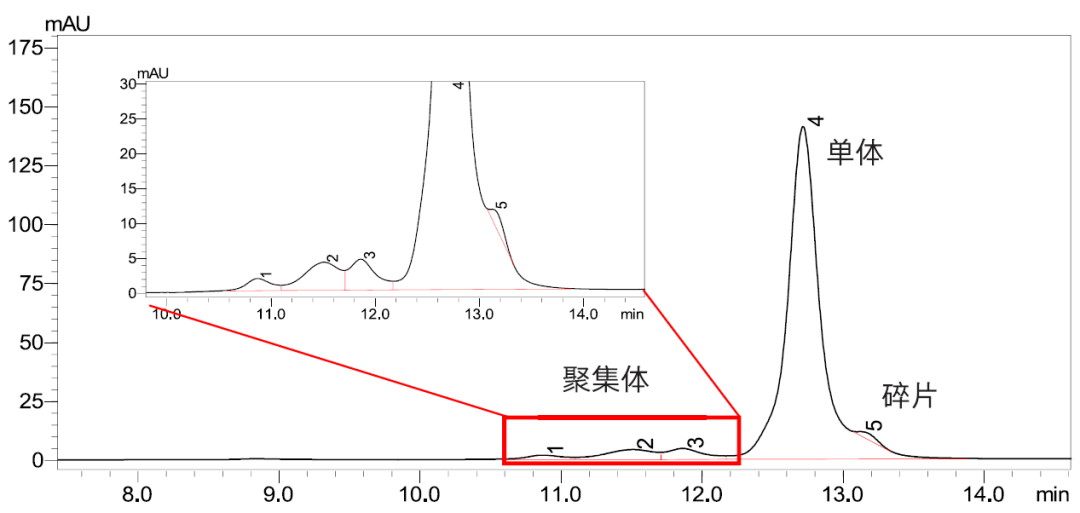
在线二维液相色谱法分析单抗药物滴度和大小变异体
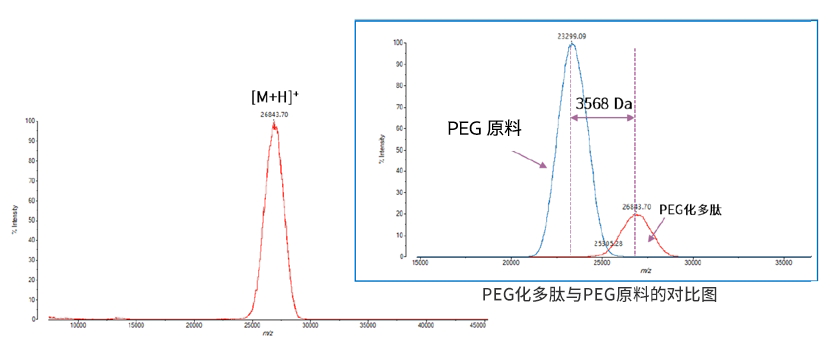
台式MALDI-TOF-MS快速分析聚乙二醇化多肽药物
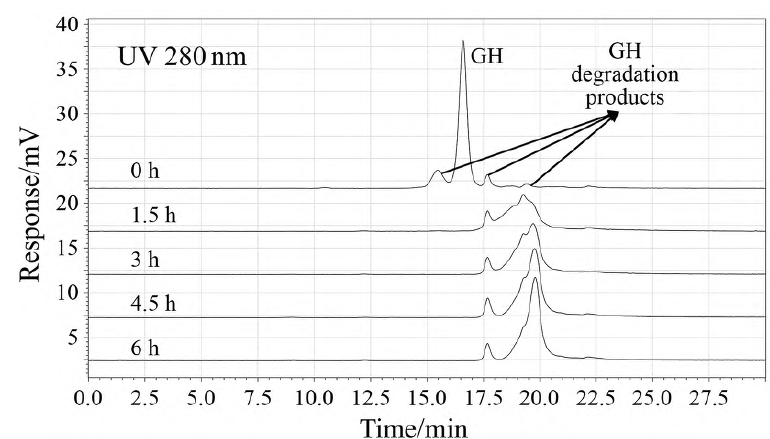

岛津SEC-UV-RI串联双检测器分析怡培生长激素注射液分析图谱
(参考文章:药学学报 Acta Pharmaceutica Sinica 2024, 59(12): 3367−3373)




