质谱成像:解锁新污染物的“空间密码”,拓展环境毒理研究新维度——你不可不知的前沿技术!


质谱成像:解锁新污染物的“空间密码”,拓展环境毒理研究新维度
✦
新污染物(如POPs 、微塑料、纳米材料等)因具有环境持久性、生物蓄积性和毒性,正成为威胁人类健康与生态安全的重要隐患。当前,环境新污染物与人体健康关联研究备受关注,其毒性效应通过“代谢-蓄积-生物分子互作”多维路径传导,与组织器官特异性分布、内源性代谢网络的时空异质性密切相关。然而,传统检测技术(如 LC、LC-MS)仅可实现污染物的定性定量分析,无法解析其在生物体内的空间异质性分布及代谢扰动机制,亟需突破 “空间维度” 的技术创新。

作为质谱技术的空间分析延伸,质谱成像技术(Mass Spectrometry Imaging, MSI)整合“定性、定位与定量” 三维分析功能,可在生物组织(从器官甚至到细胞层面)原位可视化外源性污染物与内源性代谢物的空间分布图谱(图1) 。该技术通过精准捕捉污染物在组织微区结构的特异性富集特征,动态追踪其跨生物屏障(如血脑屏障)及植物维管系统的时空迁移轨迹,并通过耦合“暴露剂量-响应”污染评估模型[1, 2],关联局部微环境中生物标志物的异常表达特征,为阐释污染物毒代动力学过程、定位细胞及亚细胞层面的毒性作用靶点、揭示组织微环境的分子应答机制,提供多维度的原位可视化分子证据[3]。
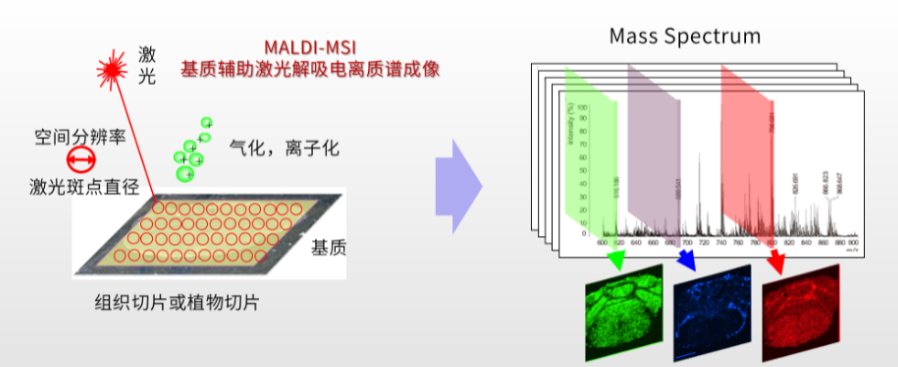
图1 质谱成像原理示意图
岛津成像质谱显微镜 iMScope QT 凭借高分辨率原位检测等诸多技术优势,突破传统匀浆分析因 “均一化处理” 导致的空间信息丢失的局限,为解析污染物在生物体内的代谢、蓄积及毒性机制提供精准技术支撑,助力环境毒理学研究及风险评估。
镜质合璧
光学显微镜与质谱成像完美融合,精准定位组织微区的分子分布动态及特异性变化。
高效高分辨分析
具备5 μm 高空间分辨率与 50 像素/秒高速扫描能力,搭载 AP-MALDI 源可实现挥发性目标物(如多环芳烃)的稳定检测
多元分析
集成 LC-QTOF 功能及专业化成像软件,实现从“靶向/非靶向分子定位”到“组学分析”的全流程覆盖。
(一)污染物分布特征解析:从器官定位到细胞微区
案例 1:纳米材料富勒醇的跨屏障迁移风险[4]
利用成像质谱显微镜,首次可视化水溶性羟基化富勒烯纳米材料 —— 富勒醇在斑马鱼组织中的分布特征(图2),发现其经水体暴露后可富集于鳃(含量最高)、肠道、肌肉并穿透血脑屏障进入脑部,并且呈现鳃丝、肠道壁细胞等组织微区的特异性聚集。研究证实,富勒醇具备潜在的跨屏障迁移能力和生物累积风险,为纳米材料生态风险评估提供细胞层面的直接证据。

图2 富勒醇在斑马鱼组织中质谱成像结果
(二)代谢扰动机制解析:污染物-代谢物共定位分析
案例 2:全氟辛酸(PFOA)的肝毒性时空效应[5]
基于成像质谱显微镜平台,成功建立斑马鱼肝脏中 PFOA 的原位可视化分析方法,发现PFOA在肝脏中呈非均匀分布,特异性富集于肝脏边缘。暴露组肝脏中15 种磷脂水平显著上调(p<0.05),其中膜磷脂 PE、PA 上调最明显(图3)。结合磷脂代谢变化与 H&E 染色病理结果可见,膜磷脂的异常上调可能破坏肝细胞膜稳定性,进而导致肝细胞水肿及肝血窦扩张等病理改变。
共定位分析显示,PFOA 与TG (54:11) 在肝边缘高度重叠,提示二者具有强结合亲和力并共存于结合位点;而与膜磷脂(PA、PS)分布模式差异显著(图4)。上述结果共同表明,PFOA 可能通过 “脂类结合”(与储存脂质 TG 结合)与 “膜结构扰动”(影响膜磷脂代谢)的双重机制引发肝毒性效应。研究首次在水生生物组织层面证实,PFOA的非均匀分布表明传统“全组织平均浓度”检测可能低估局部毒性效应,为解析 PFOA 的肝毒性作用靶点及组织微区蓄积机制提供了直接证据。
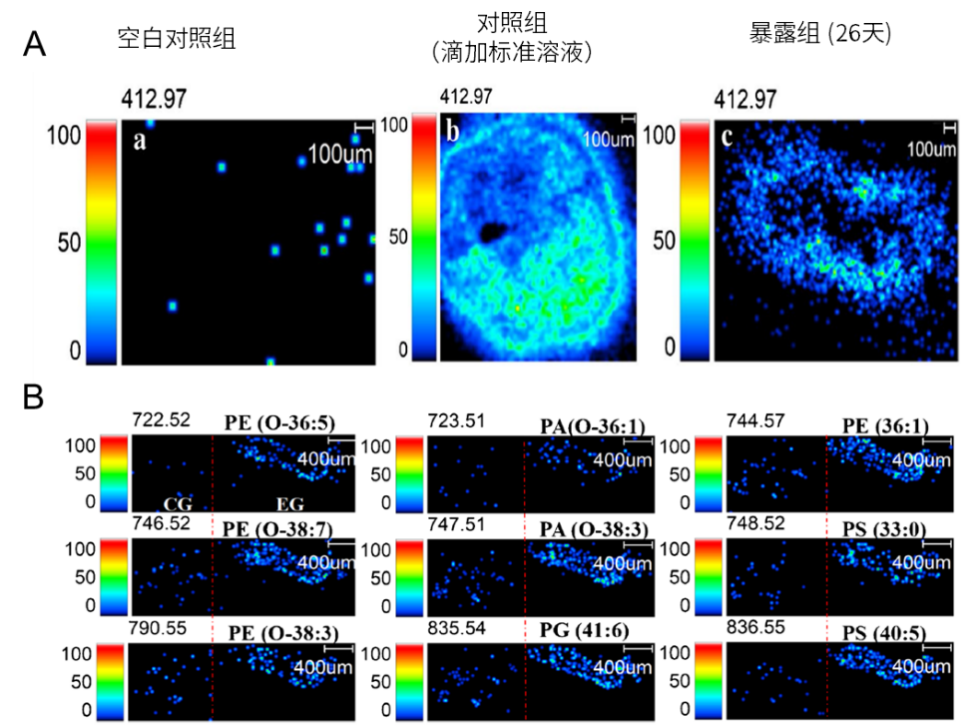
图3 斑马鱼肝脏中 PFOA 空间分布及暴露诱导的磷脂变化
(A: PFOA 蓄积分布;B: 部分差异磷脂分布特征(CG:对照组、EG:暴露组))
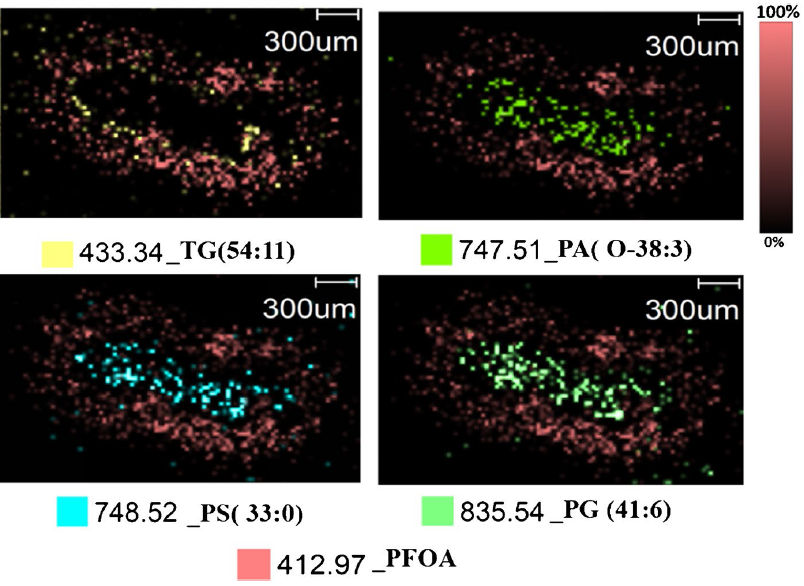
图4 不同磷脂和PFOA的共定位成像分析
(三)剂量依赖与组织特异性响应:跨器官毒性比较
案例3: PFOA 在斑马鱼不同组织中的积累和净化对特定磷脂的影响[6]
在前期研究基础上,进一步研究了PFOA暴露对斑马鱼肝脏、肠道、鳃及大脑组织中磷脂酰胆碱(PC)、磷脂酸(PA)等特定磷脂的剂量依赖性扰动及空间分布特征(图5)。结果表明,PFOA 暴露引发的磷脂代谢紊乱呈现显著的组织特异性响应差异:肝脏、鳃和脑在低剂量暴露后,其磷脂水平可通过净化过程部分或完全恢复,表现出代谢扰动的可逆性;但肠道作为直接暴露组织,其磷脂变化最广泛且不可逆,低剂量恢复缓慢,且仍高于正常水平,高剂量下损伤进一步加剧。研究证实, PFOA暴露对斑马鱼的毒性影响为:肠道>大脑>肝脏>鳃,为解析PFAS类污染物的生态毒性机制及风险评估提供了重要的时空动态证据。
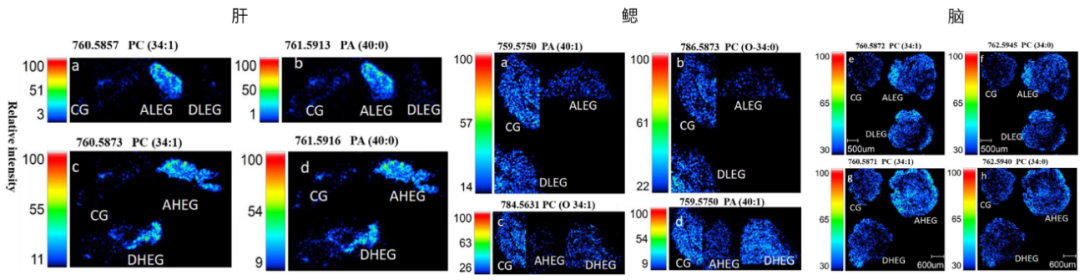

图5 PFOA暴露与净化过程中斑马鱼肝脏、鳃、脑、肠道中磷脂变化的空间分布
(CG:对照组;ALEG/AHEG:低/高剂量暴露组;DLEG/DHEG:低/高剂量暴露后净化组)
当前,MSI 技术在环境领域的应用尚处发展阶段,但其在 “原位表征污染物-代谢物时空互作”“揭示毒性作用的组织微区机制” “构建暴露动力学模型”等方面展现出独特的优势。未来,随着空间分辨率与检测灵敏度的持续提升,MSI将深度赋能新污染物的毒性机制解析、健康风险评估及防控策略制定,推动环境毒理学研究从 “宏观分析” 向 “精准可视化”发展。
参考文献:
[1]. Wang, J.,et al., Absorption and translocation of selected pharmaceuticals in Pistia stratiotes: Spatial distribution analysis using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Journal of hazardous materials, 2024. 469: p. 134028.
[2]. Bian, Y., et al., Tissue distribution study of perfluorooctanoic acid in exposed zebrafish using MALDI mass spectrometry imaging. Environ Pollut, 2022. 293: p. 118505.
[3]. 李芳与罗茜, 质谱成像技术在环境污染物分析及毒性研究中的应用进展. 色谱, 2024. 42(02): 第150-158页.
[4]. Shi, Q., et al., Visualization of the tissue distribution of fullerenols in zebrafish (Danio rerio) using imaging mass spectrometry. Analytical and bioanalytical chemistry, 2020. 412(27): p. 7649-7658.
[5]. Shi, Q., et al., Visualization of PFOA accumulation and its effects on phospholipid in zebrafish liver by MALDI Imaging. Analytical and Bioanalytical Chemistry, 2024. 416(10): p. 2493-2501.
[6]. Shi, Q., et al., Investigating the effects of PFOA accumulation and depuration on specific phospholipids in zebrafish through imaging mass spectrometry. Environmental Science: Processes & Impacts, 2024. 26(4): p. 700-709.
1、本文不提供文献原文。
2、所引用文献仅供读者研究和学习参考,不得用于其他营利性活动。
3、本文内容非商业广告,仅供专业人士参考。

本文内容非商业广告,仅供专业人士参考。






