岛津成像质谱显微镜应用专题丨米曲可视化
镜质合璧 还原真实

成像质谱显微镜用于米曲中磷脂和葡萄糖的可视化分析

引言
米曲是清酒酿造中的关键元素。它在清酒酿造中的主要作用被认为是提供分解淀粉和蛋白质的消化酶。众所周知,米曲成品的成分对清酒的品质(味道和香气)有很大的影响。然而,目前为止对米曲质量的评估经常依赖于首席酿酒师的经验。这意味着此领域相关科学知识的不足,且仍有发展空间。当首席酿酒师评估米曲质量时,米曲的物理结构,即外观和质地似乎是质量指标之一。

在过去的研究中利用扫描电子显微镜来研究米曲的内部结构,但直到近几年,评估米曲结构和成分关系的研究仍然进展甚微。由于岛津iMScope成像质谱显微镜可同时观察样品结构和成分分布,在本应用报告中,我们将iMScope应用于发酵领域,并尝试可视化分析米曲结构和成分分布。
如图1所示,质谱成像(MSI)是非常适合观察米曲结构以及决定其有效成分分布的技术。MSI应用于食品的论文,已有芦笋中天冬酰胺和姜黄根中姜黄素分布可视化的应用报告⑴,⑵。本文针对食品科学研究中的“发酵”新应用领域,尝试着将米曲内的结构和成分分布可视化。由于米曲非常易碎,在进行MSI分析时,未经前处理制作米曲切片几乎是不可能的。因此,我们研究了各种切片制备方法,并成功实现从生米到蒸米和米曲过程中的代谢物可视化分析。
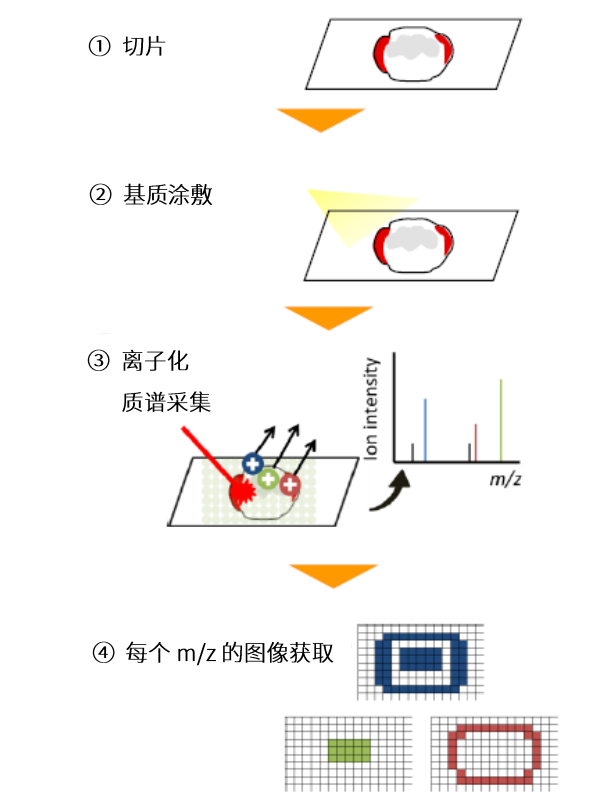
图1 质谱成像(MSI)工作流程
实验
2-1
试剂
使用羧甲基纤维素(CMC)(FUJIFILM Wako)为包埋剂,配制浓度为4%的CMC水溶液,并将溶液放入70℃的恒温箱过夜来确保完全溶解。本实验中使用的基质是α-氰基-4-羟基肉桂酸(CHCA)和N-(1-萘基)聚乙烯二胺二盐酸盐(NEDC)(Merck),溶剂为乙腈、异丙醇和甲醇(FUJIFILM Wako)、超纯水。
2-2
切片制备
使用清酒酿造用的抛光率为70%的山田锦大米(白鹤酒造株式会社)制成的蒸米和米曲。生米可视化研究中使用市售大米。如前所述,这些样品材料极其脆弱。因此,采用冷冻切片机制备切片并使用粘性冷冻膜(cryo-lab)回收获得的切片。将米粒包埋在上文所述的4%羧甲基纤维素溶液中,在-80℃冷冻。切片厚度为20 μm,获得的薄膜利用导电双面胶带(3M公司)固定在ITO涂层玻璃载玻片上(无MAS涂层,表面电阻:100 Ω/m2)(松浪玻璃工业株式会社)(图2)。

图2 米曲切片制备
2-3
基质涂敷
在检测米粒切片和米曲切片中的磷脂时,使用岛津iMLayer基质升华系统将CHCA沉积在样品表面(图3),接着喷涂CHCA溶液(3)。基质升华的膜厚度为0.5 μm。利用由乙腈、异丙醇、超纯水(3: 1: 6)构成的含0.1 %甲酸的混合溶剂溶解CHCA,调节其浓度为10 mg/mL。已知可以有效电离葡萄糖的基质NEDC,利用iMLayer进行升华,升华时设置温度为220℃、时间为10分钟。NEDC基质升华后,利用5%甲醇溶液进一步进行重结晶。

图3 iMLayer基质升华系统
2-4
质谱成像
MSI检测使用岛津iMScope成像质谱显微镜进行。激光照射次数为100次/点。正离子模式检测磷脂,空间分辨率为25 μm,负离子模式检测葡萄糖,空间分辨率为50 μm。检测范围:正离子模式m/z 400-800,负离子模式m/z 180-230。在所有检测中,激光强度均设置为45,检测器电压为2.1 kV。
2-5
构建MS图像
数据分析和MS图像构建采用岛津MSI分析软件Imaging MS Solution和IMAGEREVEAL MS进行。IMAGEREVEAL MS是通过统计学功能实现非靶向分析的软件。它拥有卓越的校正函数(图像过滤、像素插值),并含有“相似图片提取”功能。本文后半部分所示的葡萄糖可视化数据是利用IMAGEREVEAL MS软件进行分析。
结果
3-1
生米、蒸米和米曲中磷脂的分布
图4显示了生米、蒸米和米曲切片中胆碱的分布。胆碱是一种在米曲制作过程中分布和数量会发生巨大变化的典型成分。生米的结果在碾米之前测得,且结果表明胆碱累积在大米胚芽中。在碾碎后的蒸米中,来自胆碱的峰急剧下降,但在米曲的内部则观察到极强的峰。这表明胆碱在米曲发酵过程(即米曲制作过程)形成。因此,使用MSI 可以观察到米曲制作过程中胆碱数量和空间分布发生急剧变化的现象。
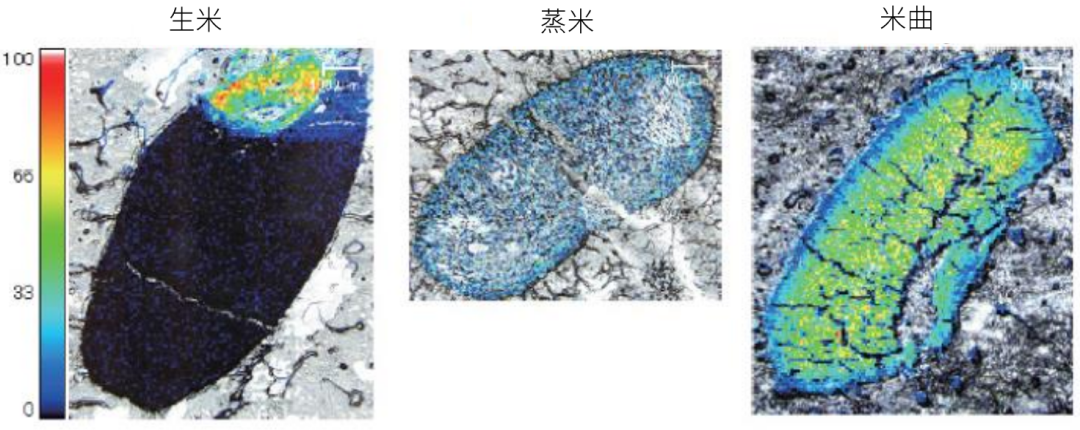
图4 生米、蒸米和米曲中胆碱的分布
在米曲的内部还观察到各种磷脂(包括溶血磷脂)的累积(图5)。尤其是溶血磷脂酰胆碱LPC(16:0),m/z 496.34和LPC(18:2),m/z 520.34显示这一趋势(4)。而磷脂m/z 748.35和786.30的MS图像显示出其在米曲中的不均匀分布。这种异质性被认为由曲霉(米曲霉,Aspergillus oryzae)侵入蒸米中生长出雾状菌丝导致,这个过程就被称为“hazekomi”。下一部分我们将介绍一种将hazekomi过程可视化的方法开发以及将这种方法与MSI结合使用的结果。

图5 米曲(山田锦,稻米抛光率:70 %)中溶血磷脂和磷脂的分布
3-2
hazekomi可视化及其与MSI的配合使用⑸,⑹
haze指的是米曲霉菌丝在蒸米表面扩散时呈现的白点,在首席酿酒师进行米曲目检时被作为一个结果指标。在早期的hazekomi可视化研究中,Yoshii等人发表了一篇基于扫描电子显微镜(SEM)观察的报告,他们通过将米曲霉传播过程直接可视化的方式成功观察到了米曲中米曲霉的生长,该结果有助于改善制曲过程(7)。
利用SEM将hazekomi过程可视化时,观察微观区域的能力是一个重要特征。不过,我们认为将整个米曲hazekomi过程可视化的方法以及可获取成分分布信息的技术也是有用的。为了解决这一问题,我们引入了采用β-葡萄糖醛酸酶(GUS)作为标志基因的GUS报告系统用于hazekomi可视化。具体来说,通过构建米曲霉GUS表达株以及生产使用该菌株的米曲(以下称为GUS米曲)来实现对制曲过程中米曲霉生长的清晰观察。GUS米曲的使用实现了通过颜色反应来可视化米曲霉位置,而当这种技术和MSI配合使用时,可获取关于成分分布的信息。这两种技术的结合同时实现了整个米曲的hazekomi可视化以及成分分布的可视化研究。
在此我们将对这种旨在把GUS报告基因系统应用于米曲的创新研究进行阐述。GUS报告基因系统最初是为了将植物组织中菌丝体的可视化而开发的。在植物组织中,常见做法是将样品浸泡在5-溴-4-氯-3-吲哚-β-D-葡萄糖苷(X-Gluc)溶液中,这是一种用于着色的显色底物。拥有极硬细胞壁的植物组织即便是长期浸泡在X-Gluc溶液中,也能够毫无问题地维持样品观察所需的形态。
不过,如前所述,米曲非常脆弱,且其性状和植物组织完全不同。这意味着采用现有的着色方案将极为困难。事实上,我们证实了在米曲浸泡在X-Gluc溶液中固定着色所需时间内,样品的形态由于吸水而发生了很大的改变。为了避免这一问题,必须改变添加X-Gluc的方式。因此,我们构思了一种通过将X-Gluc溶液喷洒在GUS米曲切片上的方法来可视化分析hazekomi过程。
图6显示了采用这种方法得到的结果。这里制曲使用的是抛光率为70%的抛光白鹤锦稻米(白鹤酒造株式会社的酒米),并在制曲开始24h、31h以及43h后取样。随着制曲的进行,可以观察到靛蓝色从曲的表面渗透到内部。尤其是在43小时之后、制曲完成时,不仅在曲的表面,在内部也能检测到浓烈的靛蓝色,表明米曲霉已经到达了稻米内部。
曲的一个主要作用是在酿造(发酵)阶段提供各种酶,以便形成酵母菌所需的营养。观察到的主要酶为α-淀粉酶或葡萄糖淀粉酶,这两者会形成作为酵母生长所需的葡萄糖。此外,也有报道表示α-淀粉酶可能是影响曲霉菌丝体侵入性生长的非常重要的酶。
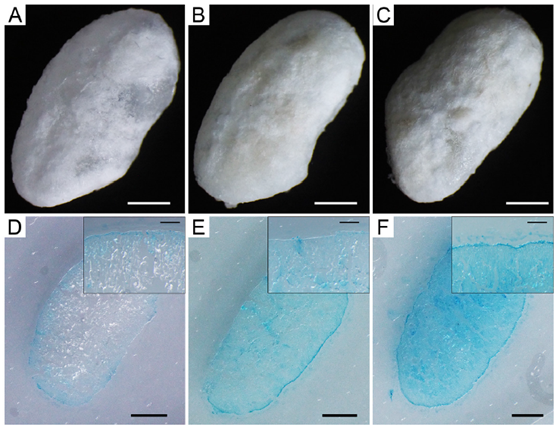
图6 GUS米曲中hazekomi过程的可视化分析(比例尺:1 mm(插入图片:200 μm))
尽管既往研究中报道了制曲后葡萄糖的增加,但hazekomi和葡萄糖分布之间的关系尚未明确。在制曲过程每个阶段的米曲质谱图中,确实观察到了葡萄糖峰强度的升高(图7)。已有报道表明NEDC可以增加癌组织中葡萄糖检测的灵敏度(8)。因此,当使用NEDC作为葡萄糖MSI的基质时,[M+Cl]-= m/z 215.02在负离子模式下被检测到。
为了研究GUS米曲的hazekomi过程和葡萄糖分布之间的关系,使用GUS染色切片相邻的切片进行了MSI,比较获得的葡萄糖离子强度和GUS染色图像的分布,图8显示其结果。
观察葡萄糖分布及与GUS染色图像的叠加可以了解到从制曲初始阶段到后期阶段,葡萄糖从外到内增加。这一结果表明hazekomi和葡萄糖分布之间存在相关性。
另外,有些区域由于X-Gluc为深色且葡萄糖强度很高而成像为蓝色(黑色箭头显示),同时在本实验中也能看到有些部分虽然也观察到了hazekomi,但葡萄糖强度低,例如以黑色圆圈表示的区域。这些结果表明位置不同,hazekomi产生的葡萄糖量存在差异性。今后,可以通过包含各种代谢物(例如氨基酸、糖类、糖醇)分析的探讨来实现从化学角度更好地了解hazekomi现象。
虽然目前的考察着重于葡萄糖并解释了伴随hazekomi过程葡萄糖分布的变化,但可以想象,形成的酶的扩散范围和活性也会受到诸如米粒特征等其他因素的影响。这种新的可视化技术(GUS米曲和MSI的融合)预期可以改进米曲和其他曲衍生产品的制曲流程。
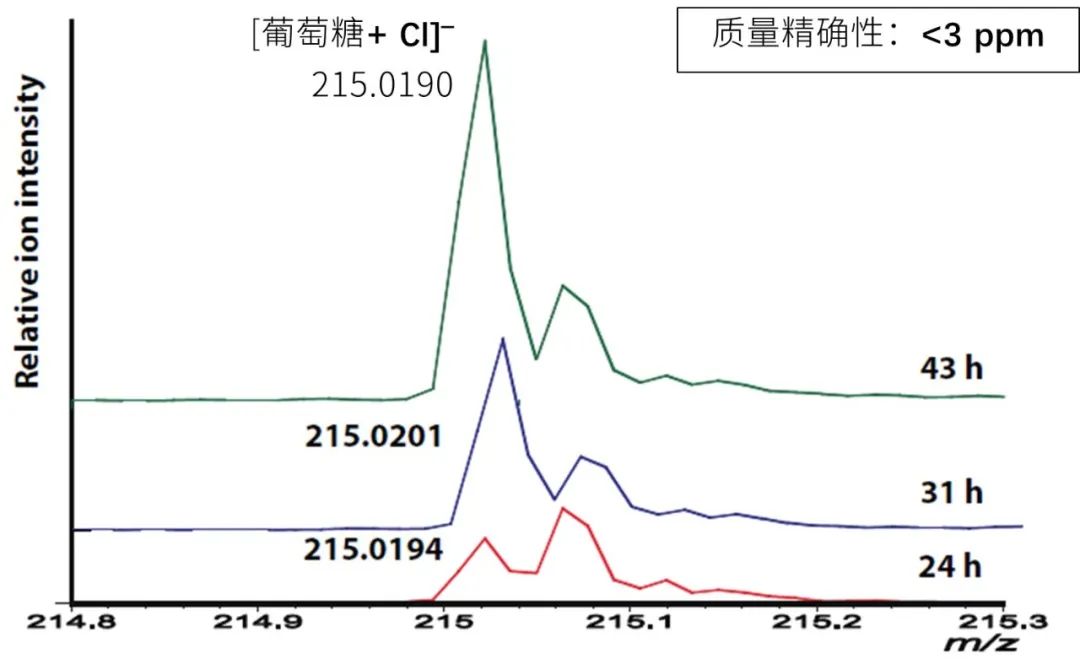
图7 利用NEDC基质获得的葡萄糖峰的时间依赖性变化
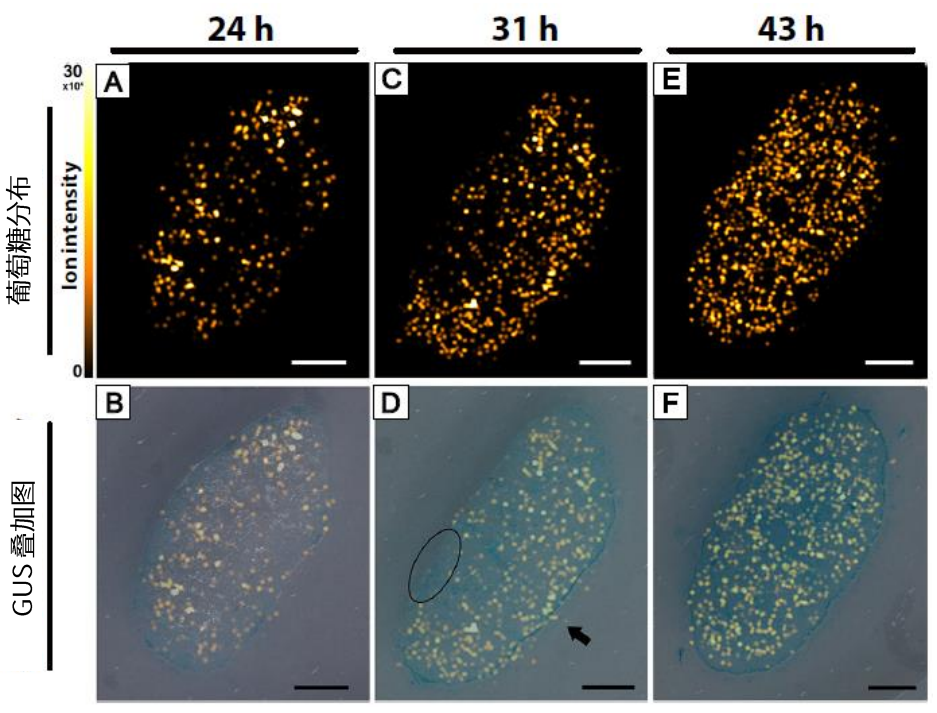
图8 GUS米曲中葡萄糖([M + Cl]–)的可视化(比例尺:1 mm)
结论
在本研究中,分析了磷脂在山田锦大米(清酒酿造米)中的空间分布,并利用白鹤锦米(白鹤酒造株式会社的专有清酒米)可视化分析hazekomi过程和葡萄糖分布之间的关系。同时还利用白鹤锦米制备了一种表达GUS的米曲品系,并用于揭示hazekomi过程和葡萄糖分布之间的关系。这种新的可视化技术利用了GUS米曲和MSI相结合,可有助于更好地了解米曲和其他曲衍生产品的制曲流程并改进制曲方法。由于本实验中采用的岛津iMScope成像质谱显微镜能同时实现微观区域的光学显微镜观察以及显微镜下的质谱分析,将iMScope应用于各种酒曲和其他麦芽的分析,可以获得发酵领域相关新科学知识。
iMScope QT(图9)是iMScope的新一代产品,于2020年6月发布。在延续iMScope TRIO卓越的显微镜观察功能和空间分辨率的同时,新的iMScope QT提供了更高的质量分辨率、检测灵敏度和分析速度,让分析变得更轻松。同时,由于能够分析更宽的质量范围,期待MSI技术可以进一步扩展在不同研究领域应用的可能性。

图 9 iMScope QT
<参考文献>
(1) K. Miyoshi, Y. Enomoto, E. Fukusaki, and S. Shimma, Shimadzu Application Note (No. 57).
(2) S. Shimma and T. Sagawa, Shimadzu Application Note (No. 63).
(3) S. Shimma, Y. Takashima, J. Hashimoto, K. Yonemori, K. Tamura, and A. Hamada, J. Mass Spectrom., 2013, 48, 1285
(4) N. Zaima, N. Goto-Inoue, T. Hayasaka, and M. Setou, Rapid Commun.Mass Spectrom., 2010, 24, 2723.
(5) A.P.Wisman, Y. Tamada, S. Hirohata, K. Gomi, E. Fukusaki, S. Shimma, J. Biosci.Bioeng., 2020, 129, 296
(6) A.P.Wisman, Y. Tamada, S. Hirohata, K. Gomi, E. Fukusaki, and S. Shimma, J. of Brew.Soc.Japan (in press).
(7) M. Yoshii and I. Aramaki, J. of Brew.Soc.Japan, 2001, 96, 806.
(8) J. Wang et al., Anal.Chem., 2015, 87, 422.
文献题目
《成像质谱显微镜用于米曲中磷脂和葡萄糖的
可视化分析》
使用仪器
岛津iMScope TRIO
作者
Shuichi Shimma *1, 2, Yoshihiro Tamada *3, Adinda Putri Wisman *1, Shuji Hirohata *3, Katsuya Gomi *4 Eiichiro Fukusaki *1,2
*1 大阪大学工程研究生院生物技术系
*2 大阪大学岛津组学创新研究室
*3 白鹤酒造株式会社
*4 日本东北大学农学研究生院未来生物产业的生物科学与生物技术系
1、本文不提供文献原文。
2、所引用文献仅供读者研究和学习参考,不得用于其他营利性活动。
3、本文内容非商业广告,仅供专业人士参考。
本文内容非商业广告,仅供专业人士参考。
扫一扫
关注我们的视频号


关注我们
及时获取科技资讯。

