前沿合作丨挖掘蓝藻中的遗传秘密—修饰核苷鉴定新思路

特邀:海南大学南海海洋资源利用国家重点实验室林桓课题组
林桓,海南大学南海海洋资源利用国家重点实验室副研究员,海南省领军人才,《Marine Resource and Ocean Science》编委,曾任岛津制作所全球应用技术开发中心副主任研究员。主要研究领域是基于高分辨以及定量质谱的核酸修饰生理学意义挖掘,在《Nature Communications》,Nucleic Acid Research等重要期刊发表过论文。
海南大学林桓副研究员团队以模式蓝藻(细长聚球藻 PCC 7942)为研究对象,与岛津广州分析中心展开深入合作,通过微流液相色谱仪(岛津Nexera Mikros)结合三重四级杆质谱仪(岛津LCMS-8050)建立了一套兼具灵敏度与特异性的修饰核苷鉴定方法,并对细长聚球藻PCC 7942 总tRNA组分中存在的修饰核苷进行了检测分析,为修饰核苷的鉴定提供了一种新思路。成果于2021年7月发表在《Journal of Separation Science》。


☆ 新思路 ☆
分析方法灵敏度提高有三种途径:
更高效的前处理技术以实现目标物的富集和基质/杂质的清除; 更优越的分离手段,得到更纯、更集中流出的色谱峰以提高目标物的瞬间浓度; 更先进的检测技术以提高目标物信号响应。
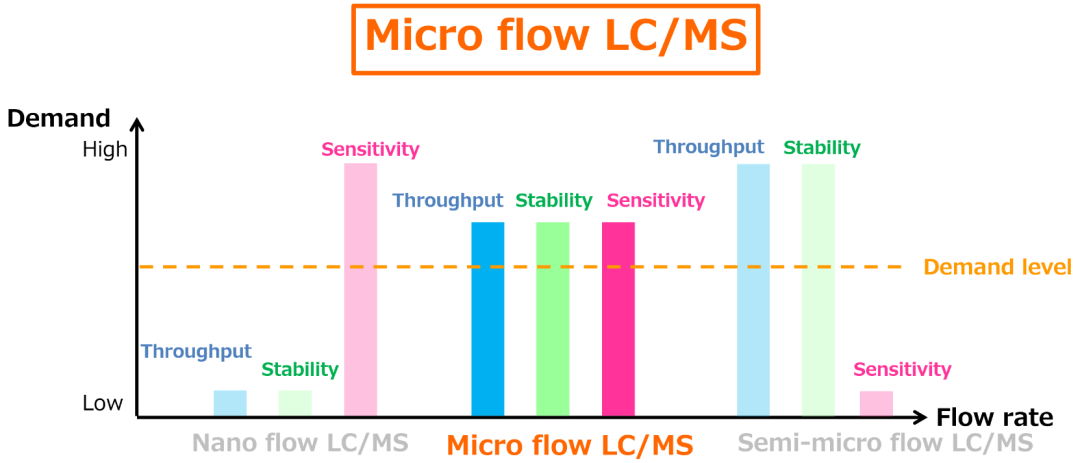
三种液相系统的性能对比

岛津微流量液相质谱联用系统 Mikros-LC+LCMS-8060
☆ 成果快览 ☆
在本研究中研究人员报道了尿苷及其衍生物在低温及高有机溶剂的条件下容易析出造成信号变动,指出了利用HILIC等亲水原理的核苷酸LCMS分析中需要注意的问题。
利用岛津微流量液相质谱联用系统测试了总tRNA组分中24个核苷标样,确定了各个标样所用的母离子和子离子,以及在HILIC色谱柱中的保留时间。通过多反应监测及保留时间,可以区分这些修饰核苷及其同分异构体。
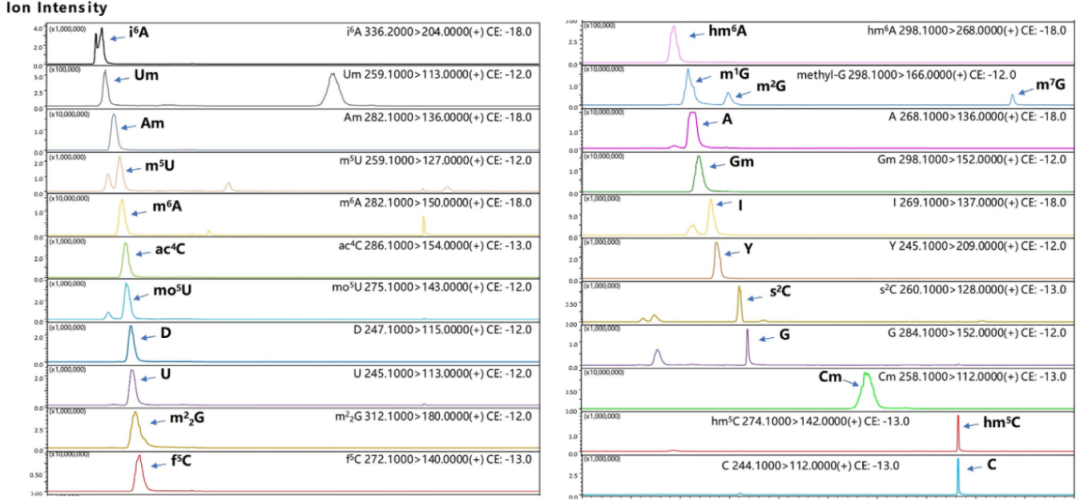
核苷标样微流量液质系统色谱图
测定了24个修饰核苷标样的最小检出量,运用微流液相色谱—三重四极杆质谱联用仪检出下限为0.1-1 fmol,而一般用于鉴定修饰核苷所用的半微流液相色谱—三重四极杆质谱联用仪的检出下限为1-10 fmol。
运用上述建立的方法,对细长聚球藻 PCC 7942中的修饰核苷进行定量检测,仅需含25 ng总tRNA组分的样品,即可得到清晰的质谱结果,而在传统的半微流液相色谱—三重四极杆质谱联用仪上得到相同结果,至少需要含100 ng的总tRNA组分的样品[6, 7]。
细长聚球藻样品图
☆ 专家观点 ☆

【参考文献】
[1] Lin H, Miyauchi K, Harada T, Okita R, Takeshita E, Komaki H, Fujioka K, Yagasaki H, Goto Y-i, Yanaka K, Nakagawa S, Sakaguchi Y, Suzuki T. CO2-sensitive tRNA modification associated with human mitochondrial disease. Nature Communications. 2018; 9: 1875.
[2] Lian H, Wang Q H, Zhu C B, Ma J, Jin W L. Deciphering the Epitranscriptome in Cancer. Trends in Cancer. 2018: S2405803318300219.
[3] Schimmel, Paul. The emerging complexity of the tRNA world: mammalian tRNAs beyond protein synthesis. Nature Reviews Molecular Cell Biology. 2017.
[4] Thomas J M, Batista P J, Meier J L. Metabolic Regulation of the Epitranscriptome. Acs Chemical Biology. 2019.
[5] Chionh Y H, Mcbee M, Babu I R, Hia F, Lin W, Zhao W, Cao J, Dziergowska A, Malkiewicz A, Begley T J. tRNA-mediated codon-biased translation in mycobacterial hypoxic persistence. Nature Communications. 2016; 7: 13302.
[6] Kimura S, Dedon P C, Waldor M K. Comparative tRNA sequencing and RNA mass spectrometry for surveying tRNA modifications. Nature Chemical Biology. 2020.
[7] Su D, Chan C T Y, Gu C, Lim K S, Chionh Y H, Mcbee M E, Russell B S, Babu I R, Begley T J, Dedon P C. Quantitative analysis of ribonucleoside modifications in tRNA by HPLC-coupled mass spectrometry. Nature Protocols. 2014; 9: 828-841.
本文内容非商业广告,仅供专业人士参考。