助力生物药研发,浅谈ADC药物DAR值测定

导语
ADC药物
带您了解DAR值如何检测
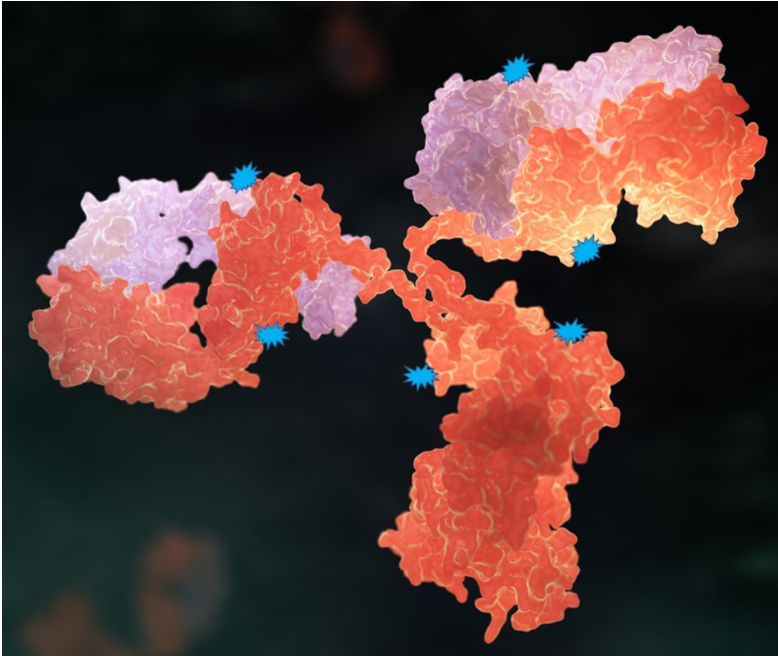
ADC药物的偶联位点分为单抗赖氨酸残基上的氨基和半胱氨酸残基上的巯基。通过赖氨酸偶联的DAR往往比较小,而潜在的偶联位点却很多,偶联反应具有随机性,产物异质性较大;ADC药物研发使用的单抗有4对链间二硫键,抗体通过部分还原使链间二硫键转换成游离的半胱氨酸残基,半胱氨酸残基中的巯基与连接子中的马来酰亚胺基反应形成ADC,一般连接的小分子数量为0、2、4、6和8,如图所示。
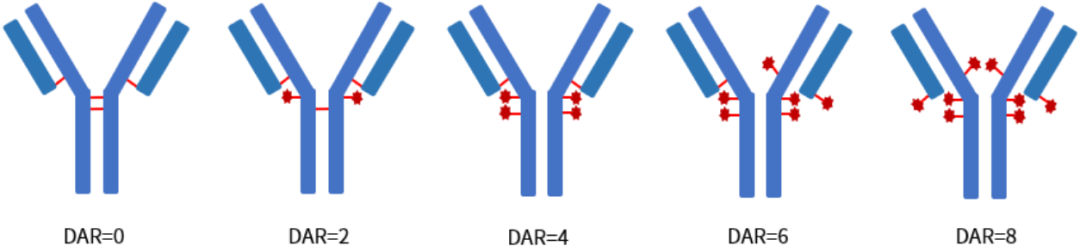
半胱氨酸偶联的ADC药物DAR分布
DAR测定的方法有多种,可分为光谱法、色谱法和质谱法,可根据ADC的特性及偶联工艺等因素选择合适的方法,具体如下:
紫外/可见光谱法(UV/Vis)
紫外/可见光谱法是检测DAR值最简单稳定的方法,这种方法需要抗体和小分子药物具有不同的最大吸收波长,分别计算二者的浓度进而得到ADC的DAR值,适用于多种ADC。
色谱法
色谱法包括疏水作用色谱(HIC)和反相高效液相色谱法(RP-HPLC)两种,适用于测定半胱氨酸偶联的ADC。疏水作用色谱法能将不同DAR值的组分根据疏水性的差异分离开,且保持ADC分子的结构完整性;反相高效液相色谱法需要先将抗体还原得到轻、重链再进行分析,可用于补充验证疏水作用色谱法的结果,并且适用于质谱分析。
质谱法
质谱法适用于赖氨酸偶联的ADC的DAR值测定,包括液相色谱串联质谱和MALDI-TOF-MS。赖氨酸偶联的ADC具有较强的异质性,增加了质谱谱图解析的难度,通常在测定前需对ADC进行额外的前处理,如去糖基化和去除C端赖氨酸异质性。
我们能做什么?
疏水作用色谱法解决方案

生物兼容液相系统(Nexera Bio)
Nexera Bio系统通过对关键部位的惰性化升级,在耐受高压的前提下,升级的惰性表面降低了生物大分子在管路进样针、检测器中的吸附,并且可耐受高盐洗脱体系,更适合于生物大分子样品的分析。通过梯度洗脱,降低盐浓度,增加有机相比例,可将偶联不同药物数量的ADC分离,未偶联药物的抗体疏水性最弱,最先被洗脱,连接8个药物的抗体疏水性最强,最后被洗脱。峰面积百分比代表特定药物数量连接的ADC的相对分布。通过峰面积百分比和偶联药物数量计算加权平均DAR。
我们将此方法应用于实际药物的分析,并进行了重复性考察,发现液相系统稳定,方法重复性良好。
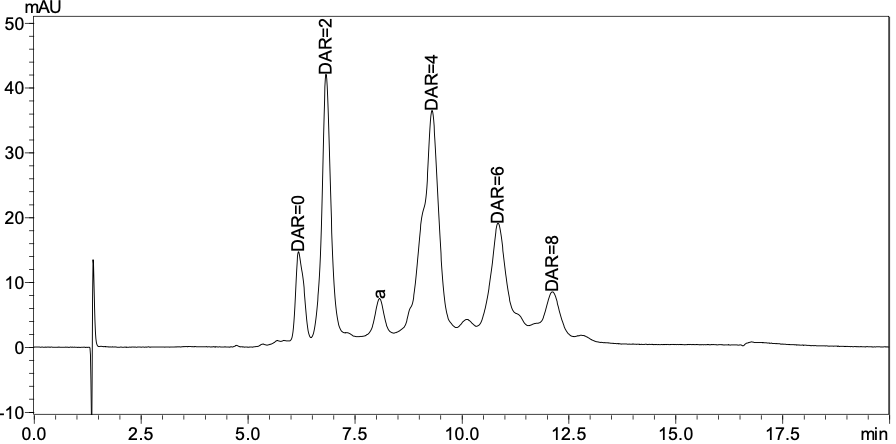
实际样品色谱图
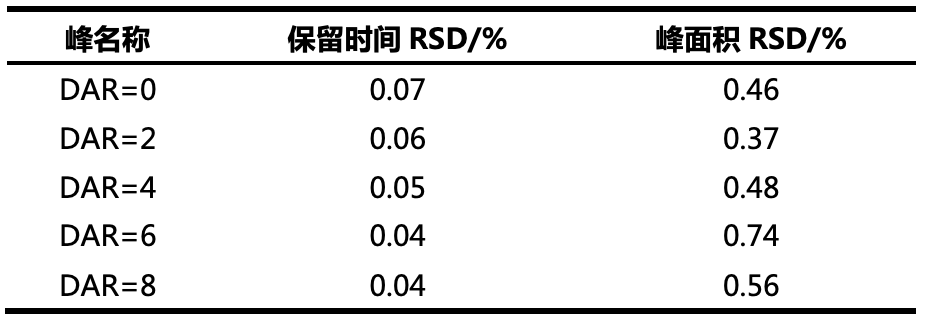
表1. 药物负荷分布和平均DAR值计算结果

我们还能做什么?
岛津的产品线比较全面,包括紫外-可见吸收光谱、高效液相色谱、LCMS-Q-TOF以及MALDI-TOF质谱,可满足不同用户对于仪器的需求,较全面覆盖ADC药物DAR值测定以及其它生物制品的研发质控。
查看更多
结语
相关阅读